以免疫检查点阻滞(Immune Checkpoint Blockade, ICB)为代表的癌症免疫疗法(Cancer immunotherapy)的出现,给癌症治疗领域带来革命性的改变。一些对传统化疗、放疗以及靶向治疗没有应答的癌症患者,在接受PD-1/PD-L1抗体或者是CTLA-4抗体治疗后,获得了非常理想的预后。
但是,大量的临床试验显示,除了部分非小细胞肺癌以及黑色素瘤等类别的癌症患者受益于免疫检查点疗法,大多数类型的癌症患者对免疫检查点疗法没有很好的应答。因此,生命科学界以及医药界都在积极探寻新的肿瘤免疫疗法。
2020年10月21日,美国纪念斯隆凯特琳癌症研究中心李明教授团队在 Nature 杂志上发表两篇“背靠背”文章——TGF-β suppresses type 2 immunity to cancer 和 Caner immunotherapy via targeted TGF-β signaling blockade in THCells ,其中,一篇是基础性研究,另一篇是转化性研究。
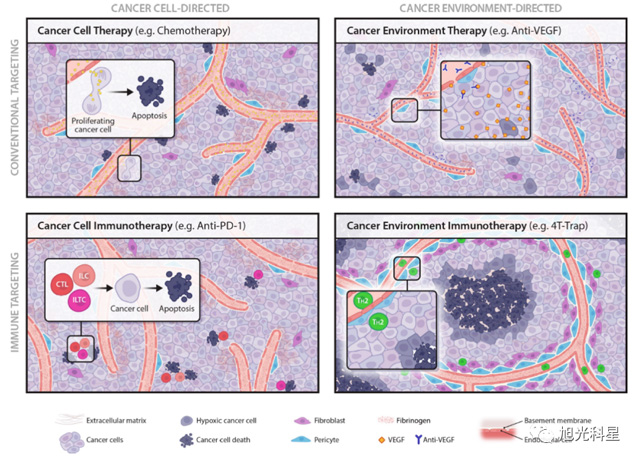
据李明教授介绍,大多数免疫疗法,包括免疫检查点阻滞和CAR-T疗法,都以致力于激活免疫系统直接杀伤癌细胞为抗癌手段。但是,肿瘤的生长繁衍也需要一个支撑环境,或者说是“避风港”。比如,它们需要血管组织来提供营养。那么是否可以通过免疫靶向这些“避风港”来间接杀死癌细胞?李明教授团队的两篇Nature论文告诉我们这种想法是可行的。
我们知道,免疫系统能精确识别并清除有害病原体,但这并不是免疫系统保护机体免受病原体侵害的唯一途径。免疫系统也能通过促进受伤组织的愈合,从而阻止病原体在体内“生根”。免疫系统的这种促进组织愈合的功能同样也能运用到抗肿瘤上。
李明教授的团队发现,通过激活免疫细胞来启动癌细胞周围的组织修复,从而抑制肿瘤的生长。在此过程中,“滋养”癌细胞的血管组织会像树枝一样被“修剪”,从而导致癌细胞因饥饿而死亡。李明教授称这种疗法为“癌症环境免疫疗法 (Cancer Environment Immunotherapy)”。
阻断辅助性T细胞上TGF-β信号通路,引发伤口愈合反应,从而重塑肿瘤血管生成导致癌细胞饥饿死亡
为了理解伤口愈合过程是如何遏制癌症生长的,我们可以想象一个人被刀划伤其伤口愈合的过程。起先,受伤的地方会发生炎症反应——变红,变热且肿胀起来。在伤口愈合的这个阶段,血管组织会扩张到伤口附近且免疫细胞会聚集到伤口杀灭能引起感染的微生物且清除细胞碎片。但是之后,伤口会逐渐被新鲜组织所填充且炎症反应会消退。
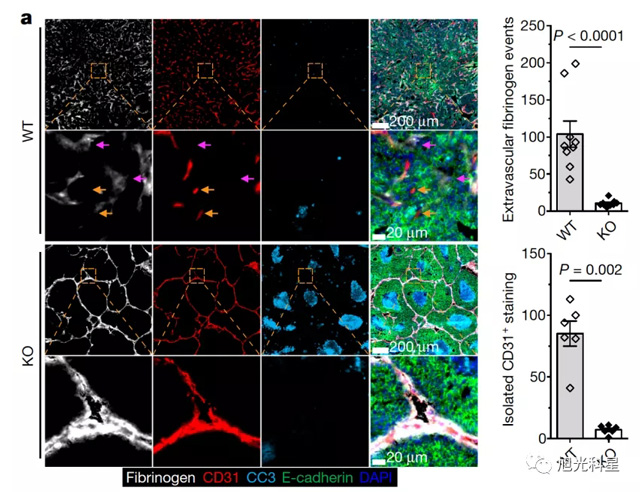
TGF-β是伤口愈合过程中一个重要的细胞分子,它会随着炎症周期而涨退。在因癌细胞生长所导致的组织损伤环境中,TGF-β持续存在且使癌细胞生长更加恶劣。而李明教授团队之前的研究就发现,阻断免疫细胞T细胞上的TGF-β表达,会抑制肿瘤的发生。李明教授团队想继续探索具体是哪种细胞在TGF-β信号阻断的情况下介导了癌细胞生长抑制的作用。他们起初怀疑是CD8+ T细胞,也称作“杀手”细胞,介导了这一作用。但是,当他们用遗传学的方法在小鼠的CD8+ T细胞上敲掉TGF-β受体的表达时,发现这对癌症生长并无影响。接下来,他们想另外一种T细胞CD4+ T细胞,也称作“辅助性”T细胞,是否能够阐释这种癌症生长抑制现象。果然,在小鼠的CD4+ T细胞上敲掉TGF-β受体的表达时,小鼠肿瘤生长受到严重抑制。
那么,CD4+ T细胞是如何在TGF-β信号通路受阻的情况下控制癌症生长的呢?李明教授和他的团队发现这些细胞是通过促进肿瘤组织的伤口愈合过程来实现抗肿瘤目的的。在这个过程中,为肿瘤组织提供营养的血管组织生长模式被重塑,且血管周围形成一堵致密的“保护墙”,从而阻止癌细胞摄取营养物质。
这些研究结果,发表在第一篇 Nature 论文上,作者显示在CD4+ T细胞上阻断TGF-β信号通路,能够激活强大的伤口愈合反应,从而阻止癌细胞的生长。
但是,如果肿瘤的生长已经形成,是否通过阻断TGF-β信号通路依然能够阻滞肿瘤生长?在第二篇Nature 论文中,李明教授团队回答了这个问题。
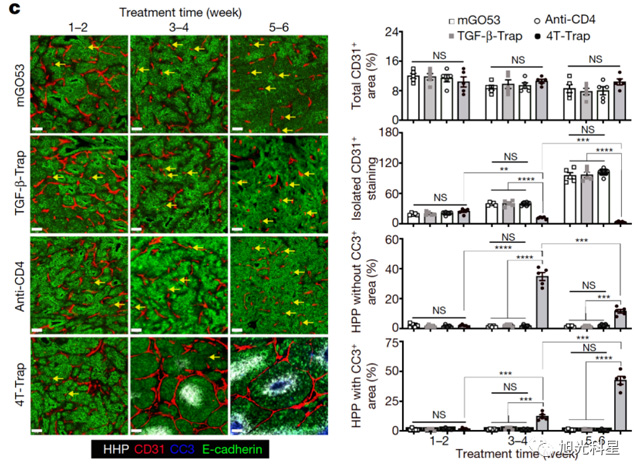
4T-Trap重塑肿瘤血管的形成,从而抑制肿瘤的生长
他们设计了一种抗体药物,这种药物既能够结合TGF-β,又能够结合辅助性T细胞。他们命名这种双特异性抗体药物为4T-Trap,并发现其能够显著抑制小鼠的肿瘤生长。很多TGF-β抑制剂被尝试过其抗肿瘤效果,但是一直以来都没实现临床上的成功,其原因可能是TGF-β功能很丰富,作用太广泛,通过药物完全抑制它可能会有很大的副作用。而4T-Trap能直接且特异性的靶向CD4+ T细胞上的TGF-β信号通路,因此副作用大大的减少。并且,4T-Trap能够特异性地进入肿瘤导流淋巴结,在那里拮抗肿瘤抗原呈递过程中所激活的CD4 T细胞TGF-β信号通路,而这些都是普通TGF-β抑制剂所不能实现的。
如果说CD4辅助性T细胞比CD8杀伤性T细胞在抗肿瘤作用上更加关键,很多学者会觉得很奇怪。因为CD8杀伤性T细胞是当下研究的热点,且大家都有一种固有思维,认为T细胞介导的抗肿瘤作用,都是CD8杀伤性T细胞介导的,而不是CD4辅助性T细胞。而这种CD4辅助性T细胞介导的抗肿瘤作用,打破了这种固有思维,也让大家重新认识到CD4辅助性T细胞在肿瘤免疫中的作用。
李明教授指出,他们研究中关于肿瘤与伤口愈合的关系并非是完全首创。事实上,在1980年中期,癌症学家Harold Dvorak就在《新英格兰医学期刊》上发表论文且指出肿瘤实质上就是“不能愈合的伤口”, 这与他们的发现不谋而合。肿瘤通过组织损伤早期引发的炎症反应和血管新生来促进其生长,而当血管完整扩张到损伤组织时,肿瘤却永远不会进入到伤口愈合的后期。而通过阻断辅助性T细胞上的TGF-β信号通路,我们可以让肿瘤完整地完成伤口愈合过程。通过回顾前人的研究,他们的发现回应了之前的猜想,这也是一项令人激动的回归性研究。
癌症疗法的分类
最后,李明教授指出,这种癌症环境免疫疗法,很可能是一类新型的癌症疗法,是对现有癌症疗法的一种重要补充。目前,他正在联合纪念斯隆凯特琳癌症中心的医生们一同将这种疗法推向临床。
论文链接:
https://doi.org/10.1038/s41586-020-2836-1
https://doi.org/10.1038/s41586-020-2850-3
原标题:同期两篇Nature!从基础研究到药物研发,李明团队发明“癌症环境免疫疗法”
来源:Bio生物世界 2020-10-22
返回